《水动力学研究与进展》
基因编码二维红外探针研究酶活性中心柔性研究
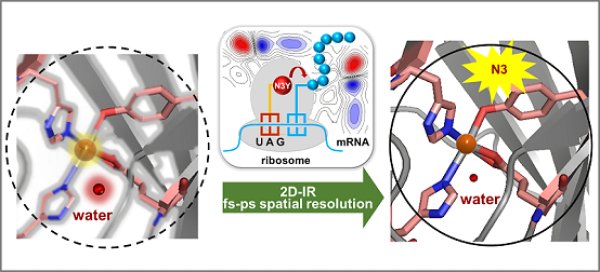
来源:水动力学研究与进展 【在线投稿】 栏目:综合新闻 时间:2021-03-043月1日,《德国应用化学》发表了中国科学院生物物理研究所王江云课题组、物理研究所李运良课题组及福建物质结构研究所庄巍课题组,以A genetically encoded two dimensional infrared probe for enzyme active-site dynamics为题的研究论文。论文报道了一种新的二维红外探针间叠氮酪氨酸(N3Y),通过在铁依赖性酶DddK的活性位点上的基因掺入,二维红外监测及分子力学计算表明,由于活性中心水运动受限降低,活性中心铁氧化生成Fe(Ⅲ)和加入变性试剂均使酶活性显著降低。
酶通过从飞秒到秒的各种时间尺度上运动进而执行重要的生物功能,关于缓慢运动(即毫秒到秒)如何影响底物结合和产物释放的已有许多已知信息,而对于飞秒(fs)到皮秒(ps)时间尺度上的快速运动对酶活性的影响知之甚少。二维红外(2D-IR)光谱固有的快速时间分辨率,特别适合监测蛋白质结构周围的水和离子fs-ps时间尺福动力学。近年来,蛋白质位点特异性红外探针的发展提高了时间分辨红外技术的空间分辨率,使其成为蛋白质动力学研究的重要工具。例如,基因编码的非天然氨基酸如对-叠氮基-L-苯丙氨酸和对-氰基-L-苯丙氨酸,已用于跟踪局部电场,表征蛋白质折叠动力学和蛋白质/蛋白质相互作用。然而,由于苯丙氨酸侧链多埋在蛋白质疏水核心内,通常不直接参与酶催化,这些基因编码的苯丙氨酸类似物在探索酶活性位点动力学方面的应用有限。酪氨酸残基普遍存在于许多酶的活性部位,常作为亲核试剂,质子供体,能参与氧化还原反应,具有形成阳离子-π相互作用及与金属离子配位等功能。酪氨酸残基在核酸生物合成、DNA修复、细胞色素氧化酶的氧还原、PSII的水氧化,以及其他生物过程中具有关键作用。然而,酪氨酸类似物作为2D-IR探针专门引入蛋白质中尚未有研究。
研究中,科研人员利用基因密码子扩展手段,实现了一种新的二维红外探针N3Y的基因编码,并在一种铁依赖性酶DddK的活性位点实现了N3Y的基因掺入。DddK是一种金属酶,它能将地球上丰富的有机硫分子二甲基磺酰丙酸(DMSP)转化为二甲基硫化物(DMS,海洋硫循环中的一个中心分子,在气候调节中具有重要作用)。通过2D-IR测量及分子动力学计算研究证明DddK中心铁原子氧化还原态的变化对ps-fs时的水的动力学有较大影响,表明N3Y是一种对环境敏感的二维红外探针。
中科院院士邹承鲁多年前做了观察研究,在加入低浓度的蛋白质变性剂导致酶活性完全丧失,而蛋白质的整体结构仍能保持完整。基于这些结果,提出了酶的柔性活性中心这一重要概念(Tsou,1993,Science),认为酶活性中心是高度柔性的结构。在本项研究中,低浓度变性剂的加入也强烈影响DddK活性位点的水动力学,而不引起蛋白质结构的整体变化。在DddK活性部位降低对水分子运动的限制与酶活性降低有关。该研究为低浓度的蛋白质变性如何显著降低酶活性位点对水的限制提供了新的见解,为低浓度的蛋白质变性试剂能够消除酶活性而不引起整体蛋白质结构的改变提供了机理研究基础。由于酪氨酸残基在许多关键酶中起重要作用,基因编码的2D-IR探针N3Y应该广泛适用于研究酪氨酸的多种功能以及ps-fs时间尺度酶活性位点动态对酶选择性和活性的影响,从而促进特定的化学反应。
该研究由生物物理研究所,天津工业生物技术研究所、物理所和福建物构所合作完成。生物物理研究所核酸生物学重点实验室研究员王江云研究员、刘晓红,与物理所研究员李运良、福建物构所研究员庄巍为论文的共同通讯作者,生物物理所博士研究生汪莉、福建物构所研究生张佳、物理所研究生张璐,天津工生所助理研究员韩明杰、博士研究生陈超和助理研究员黄爱萍为论文的共同第一作者。研究工作得到科技部、国家自然科学基金委员会和中科院的支持,并获得生物物理所蛋白质科研平台的帮助。
基因编码二维红外探针研究酶活性中心柔性
【来源:生物物理研究所】
声明:转载此文是出于传递更多信息之目的。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 邮箱地?/p>